KISALTMALAR
YDK; yarım daire kanalı (SSC)
SNİK; sensöri-nöral işitme kaybı (SNHL)
İK; işitme kaybı (HL)
BT; bilgisayarlı tomografi
MR; manyetik rezonans
GVA; geniş vestibüler akuaduktus (LVA)
CND; kohlear sinir yokluğu
IAC; internal akustik kanal (İAK)
CI; kohlear implant
AFH; Anderson-Fabry hastalığı (AFD)
CPA; serebello pontin açı
GİRİŞ
Çocuklardaki en yaygın özürlülük hali sensöryal tip işitme kaybıdır (SNİK sensorineural hearing loss). Yenidoğan prevelansı 1-2/2000, 18 yaşına kadar ise 6/1000 olarak rapor edilmiştir.1 İşitme kaybının geç anlaşılması sonucunda konuşma ve dil gelişimi geri kalmakta, akademik, sosyal ve emosyenel gelişimde gecikmelere neden olmaktadır.2 ABD Evrensel Yenidoğan İşitme Taraması Enstitüsü işitme taraması yaşını 2-3 aya kadar düşürmüştür.3 Ülkemizde de yenidoğan döneminde tüm çocukların işitme taramaları yapılmaktadır.
Kesitsel görüntüleme çalışmaları SNİK araştırmaları için tamamlayıcı bir enstrüman olmuştur. Bugün BT ve MR bu tip çocuklarda temporal kemik anatomisinin ve santral işitsel yolların ve hatta intrakranial diğer patolojilerin araştırılması için rutin kullanılır hale gelmiştir.
İŞİTME KAYBI BULUNAN ÇOCUĞUN GÖRÜNTÜLENME TEKNİKLERİ
Yenidoğan işitme taraması olarak transient OAE taraması ile testden kalan çocuklar 15 g sonra tekrar test için çağrılır. OAE taramasından tekrar kalırsa, kulak muayenelerinin ardından OAE tekrarlanır. Testden kalırsa tarama ABR yapılır. Geçer sonuç alamazsa "İşitme Kaybından Şüphelenilen çocuk" tanısı ayrıntılı bir anamnez ve tam KBB muayenesinin ardından tercihen doğal uyku altında klinik ABR testi yapılır. Doğal uyku altında test mümkün olmazsa sedasyon veya genel anestezi dahi uygulanabilir.
İşitmenin normal olmadığı tespit edilirse ayrıca göz muayenesi (Usher sendromu, diğer göz tutulumları), kardiyoloji muayenesi (12 kanallı EKGile uzamış QT? Jervell veya Lange-Nielsen vb), radyolojik incelemeler, CMV araştırması, genetik konsultasyonu ve connexin proteini ile ilişkili genetik testler yapılmalıdır.3
Radyolojik olarak hem BT hem MR tekniklerinin birlikte kullanılması çok daha geniş bir yelpazede incelemenin yapılmasını sağlayacaktır. MR yumuşak dokular hakkında çok iyi fikir verirken, radyasyon tehlikesinin olmaması avantajlı yönleridir. Neoplasm veya enfeksiyon olmadığı sürece genellikle kontrast maddeye ihtiyaç duyulmaz. BT ise kemik dokular hakkında çok iyi detay verirken ucuz ve kısa sürede yapılabilen bir teknik olup, genellikle sedasyona gerek duyulmaz.4
BT Endikasyonları
i. YDK defektleri veya cochleavestibüler anomaliler tanımlandığında, özellikle fasial kanal ve kohleanın kemik kanallarının tespiti için,
ii. İç kulak obstruksiyonu durumunda, bunun fibröz doku mu, yoksa ossifikasyona mı ait olduğunun ayrılması için,
iii. IAK darlığında, kohlear sinir kemik kanalının görüntülenmesi için,
iv. İletim tipi işitme kaybı durumunda ossiküler zincirin görüntülenmesi için.
ÇOCUKLUK ÇAĞI İŞİTME KAYIPLARI
Etiyolojik faktörleri Konjenital ve Kazanılan olanlar olara iki ana gruba ayırabiliriz. Konjenital olanlar kendi içinde genetik ve non-genetik olarak ikiye ayrılabilirken, genetik olanları da sendromik ve non-sendromik başlıkları altında incelemek uygun olacaktır.
KONJENİTAL İŞİTME KAYIPLARI
Doğuşta var olan işitme kayıpları genetik ve non-genetik olarak iki grupta incelenebilir. Konjenital işitme kayıplarının yarısından çoğu herediter geçişlidir. Bunların %75-80'i OR, %15-20'si OD ve %1-2'si X-e bağlı, yine %1-2 gibi küçük bir grup mitokondrial genlerle geçiş gösterir. Genetik olguların yaklaşık %30'u sendromiktir. SNİK oluşturan 300'ün üzerinde tanımlanmış sendrom vardır. Non-herediter olguların yaklaşık yarısı çevresel etkenlere bağlı olup, kalanı idiopatiktir.5
Konjenital SNİK olgularının ancak %20-30'unda radyolojik görüntüleme ile tespit edilebilen bir iç kulak anomalisi bulunur.6 Bunun nedeni izole anomalilerin büyük çoğunluğu hücresel veya mikroskopik seviyede oluşmaktadır.
NON-SENDROMİK HEREDİTER İŞİTME KAYBI ETKENLERİ
Herediter SNİK etkenlerinin %70'i non-sendromiktir. Tanımlanmış yaklaşık 110'un üstünde kromozom loci ve 65 gen vardır.7 Non-sendromik HL geçişleri genetik patern olarak 4 ayrı geçiş özelliği gösterir (tablo). Non-sendromik herediter işitme kayıplarının %80'i OD geçişlidir ve HL genellikle 10-40 yaşlarda başlar ve progresif özellik gösterir. OR geçişli olanlar yaklaşık %20 olguda bulunur ve genellikle konjenitaldir. OR olanlarda çok ileri derecelerde HL oluşur. X-linked ve mitokondrial olgular yaklaşık %1-2 görülür. Mitokondrial genlerle geçenler 5-50 yaşlarda başlayabilir ve progresif ve değişik seviyelerde HL oluşturur. OR ve mitokondrial geçişlilerin prevelansı yaş ilerledikçe artarken, OR olanlarınki azalma gösterir.
Bu guruptaki olguların yaklaşık yarısında prelingual SNİK etkeni olarak gap-junction connexin 26 proteninin kodlamasıyla ilgili GJB2 gen mutasyonları sorumlu tutulmaktadır.8 GJB2 mutasyonlarıyla oluşan işitme kayıplarında iç kulak malformasyonları çok nadir olup, radyolojik görüntüleme tekniklerine gerek yoktur.9 Ancak bu görüşün tersini savunan bir çalışmanın bildirdiğine göre bialleic GJB2 mutasyonu olan olguların %72'sinde, en sık hafif endolenfatik fossa genişlemesi, modiolar hipoplazi gibi bulgular olmak üzere en az bir anomali saptanabilmektedir.10
Non-sendromik işitme kayıplarında en sık görülen iç kulak malformasyonu %10-15 oranıyla GVA olmaktadır.11 GVA olguların yaklaşık %90'ında bilateraldir ve işitme kaybı çok ileri konjenital SNİK, progresif SNİK veya fluktuasyon gösteren SNİK formlarında oluşabilmektedir. Başlangıçta işitme kaybı yüksek frekanslarda görülmekte ve bazı hastalarda küçük kafa travmaları, fazla eksersiz veya barometrik değişikliklere (uçak yolculuğu, dalgıçlık, Valsalva manevrası, vb) bağlı akut işitme kaybı şeklinde de görülebilmektedir.12 GVA olgularının yaklaşık %63'ünde 7j31 kromozomu PDS lokusunda mutasyon görülmektedir. Aynı mutasyon Pendred sendromundan da sorumludur.14
İÇ KULAK MALFORMASYONLARININ SINIFLAMASI
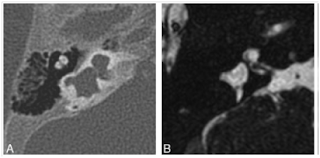
İşitme kaybına neden olan iç kulak malformasyonları yenidoğan döneminde saptanırken, geniş vestibüler aquaduct gibi sonradan işitme kaybı oluşturabilen malformasyonlar zamanla tespit edilebilir. Embriyogenezisin değişik aşamalarında oluşabilen etkilenmelere göre farklı malformasyonlar görülmektedir. Gebeliğin 3.haftasında otic placode gelişimini engelleyen patolojilerde total labirentin aplazi gelişebilir ki Michel anomalisi olarak tanımlanır (Şekil 1). Gebeliğin 7.haftasından sonra oluşan etkilenmeler daha hafif anomalilere neden olur ki Mondini aplazisi veya diğer bir isimlendirmeyle İnkomplet partitisyon tip II olarak tanımlanır (Şekil 2).
Şekil 1: Michel Labirent aplazisi. Aksiyel (A) ve koronal (B) kesitlerde normal iç kulak yapıları bulunmamaktadır. İyi gelişmiş bir iç kulak kanalının olmayışı, tabloyu labirentitis ossifikans olgusundan ayırmaktadır.
Şekil 2: İnkomplet partitisyon II (Mondini aplazisi). Modiolus yokluğu ve kohlear apeks ile orta kanalın birleşiminden oluşan büllöz apeks görünümü. Vestibül ve YDK normal, vestibüler aquadukt geniş değil.
Sennaroğlu ve Saatçi 2002 yılında iç kulak malformasyonlarıyla ilgili bir sınıflama sunmuşlardır (tablo).13
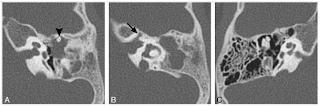
Bu sınıflamada Michel aplazisi "Total Kohlea ve Vestibül Aplazisi" olarak tanımlanır (Şekil 1). Gebeliğin 3-4.haftalarındaki etkilenmeler vestibül vardır ve "Kohlear Aplazi" olarak tanımlanmıştır (Şekil 3).
Şekil 3: Kohlear aplazi. Vestibül displastik olup lateral kanal ile anormal bir birleşme göstermekte. Vestibüler sinir kanalı daralmış (ok).
Gebeliğin 4.haftasındaki etkilenmelerde kohlea ve vestibül ayırımı olmaksızın tek bir boşluk halinde gelişimle karşılaşılır ve "Common Cavity" olarak adlandırılır (şekil 4). Gebeliğin 5.haftasındaki etkilenmelere bağlı kistik kohleavestibüler malformasyon (Incomplate partitation-I) oluşur ki, modiolus ve kribriform bölge gelişmemiştir ve kohlea ile vestibülde kistik gelişim görülür (Şekil 5).
Şekil 4: Common Cavity deformitesi. Aksiyel (A) ve rekonstruktif (B) görüntülerde kohla ve vestibül tek bir boşluk halinde olup, farklılaşmaları gelişmemiştir.
Şekil 5: İnkomplet partitisyonda kohlea ve vestibül birbirinden tam ayrılamamış ancak ayrılma prosesi başlamıştır. Böylece kohlear ve vestibüler kaviteler bir arada kistik bir formasyonla "8" figürü veya "Kardan Adam" manzarası oluşturur.
Gebeleğin 6.haftasındaki etkilenmeler sonucunda kohlear hipoplazi oluşur. Kohlea ve vestibül kısmen ayrılmıştır ancak kohlea çok küçük yapıda olup, interenal akustik kanalın ucunda bir tomurcuk gibi görülür (Şekil 6). Gebeliğin 7. haftasında oluşan etkilenmelerde kohlea gelişimini yaklaşık 1,5 tur olarak gerçekleştirebilir, apeks ve ikinci döngüsü bir arada olup, kistik bir görünüm sergiler (Şekil 2).
Şekil 6: Kohlear hipoplazi. Kohlea internal akustik kanalın ucunda tomurcuk gjbi gürünür, Vestibül geniş ve diplastiktir, LSK ile cep şeklinde birleşmiştir.
GVA SNİK'na yol açabilen en sık görülen iç kulak anomalisidir. Tek başına görülebildiği gibi IP-II, vestibüler genişleme (Vestibular Enlargement), yarım daire kanalı displazisi gibi anomaliler ile birlikte de görülebilir. BT ile 1,5 mm'den daha geniş görülmesiyle tanı konulur. Bu genişlik yaklaşık posterior YDK'nın orta yerindeki genişliğine karşılık gelir.12 MR ile endolenfatik kanal ve kese genişliklerine de rastlanılabilir (şekil 7). Endolenfatik kanal genişliği genellikle GVA ile birlikte görülse de, izole olarak da bulunabilir.
Şekil 7: A.Geniş vestibüler akuaduktus, kanalın çapı komşu YDK'dan daha geniştir. Aynı zamanda IP-II deformitesi de bulunmaktadır. B.Geniş endolenfatik kanal ve kese olgusu.
YDK malformasyonları da sık görülen anomalilerdir. Gebeliğin 6.haftasında vestibüler apendiksten disk şeklinde bir bölüm içeri doğru çökme (evagination) yapar. Diskin orta bölümü rezorbe olurken yerine mesenkimal doku gelir. Bu yapı karakteristik olarak YDK'a dönüşür. Disk oluşumu etkilenirse ilgili YDK gelişmeyecektir. Disk merkezinin yetersiz absorbsiyonu durumunda ise displastik veya cep-tipi (pocket-shape) YDK oluşacaktır. İlk gelişen superior kanal, sırasıyla posterior ve lateral YDK'lar gelişmektedir. Lateral YDK anomalileri izole olarak görülebilmektedir (şekil 8).
Şekil 8: A.Displastik lateral YDK, kanal vestibül ile birlikte ve cep görüntüsü oluşturuyor. B.Koronal kesitte superior ve posterior kanallar normal iken, lateral kanal devamlılığı kesilmiş durumda görülüyor.
Waardenburg ve Alagille sendromunda farklı olarak anterior ve lateral kanal anomalileri yok iken posterior kanal aplazisi görülür. Aksiyel BT kesitinde lateral YDK seviyesinden geçen kesitte lateral kanal ortasındaki kemik adanın genişliği normalde 2.6-4.8 mm aralığında olmalıdır. Bu kemik adanın dar olması gizli bir YDK anomalisi olduğuna işaret edebilir (Şekil 9).15
Şekil 9: Lateral kanal adası 1.9 mm çapla küçük olarak tespit edilmiştir ve SCC dispalizisine işaret etmektedir. Aynı zamanda vestibül genişlemiş ve kohlea hipoplaziktir.
Daha hafif iç kulak malformasyonlarında (GVA, IP-II, parsiyel YDK displazisi) kohlear implant uygulaması sonrasında, diğer malformasyonlara (common cavity, kohlear hipoplazi) veya CHARGE sendromu gibi sendromlara göre konuşmanın algılanmasıyla ilgili daha iyi sonuçlar alınabilmektedir.16 İç kulak anomalilerinin saptanması kohlear implant cerrahisi açısından çok önem arzeder, çünkü elektrot yerleştirilmesi zorlaşmakta, perilenf veya BOS fistülleri oluşabilmekte, implantasyon sonrası menenjit gelişebilmekte, yanlış elektrot yerleştirilmesi oluşabilmekte hatta iç kulak kanalına geçebilmektedir. Dahası bu olguların %15-32'sinde fasial sinir yerleşimi farklı olabilmekte, yuvarlak pencere içinden optimal giriş açısını değiştirebilmektedir.
KOHLEAR SİNİR BOZUKLUĞU
Kohlear sinir bozukluğu (CND - cochlear nerve dysplasia) işitme sinirinin tam yokluğu yada çap olarak ince olmasıdır. CND yenidoğan SNİK olgularının %12-18'inde görülür. Genellikle konjenital olarak görülür, ancak çok nadiren erken çocukluk döneminde sinirin atrofiye uğramasıyla da meydana gelebilir.17 CND durumunda kohlear implant uygulaması kontrendikedir. Kohlear sinirin kanal içindeki durumunun en iyi tespiti MR ile mümkündür. Kanal dik açıda yapılan konstruksiyonda kohlear sinir kanalın ön alt kadranında yer alır. Ön üstde fasial sinir, arka kadranlarda vestibüler sinirler yer alır (Şekil 10). Kohlear sinir, vestibüler sinir ile birlikte 8.sinirin total yokluğu, yada izole olarak kohlear sinirin yokluğu şeklinde görülebilmektedir. CND sıklıkla İAK (internal acoustic canal) darlığı ile birliktedir. Sinir aplazilerinde kanalın normal genişliğe ulaşamadığı, çapının 4 mm.nin altında kaldığı öne sürülmektedir.17
Şekil 10: A. Sağ İAK içinde ön altda kohlear sinir görülmüyor. B. Sol İAK içinde ön altda kohlear sinirin görünüşü.
CND saptanmasında MR altın standarttır ancak BT ile de BCNC (bony canal nervus cochlearis) çapının darlığı (normali 1.4-3.0 mm) veya, İAK stenozu saptanabilir. İAK darlığı bulunan olgularda CI cevapları daha kötü seyretmektedir, bunun nedeni muhtemelen kohlear sinirin hipoplazik veya aplazik olmasıdır.16 Kohlear sinirin olmadığı olguların yaklaşık %23'ünde BCNC normal,18 %73'ünde İAK normal genişlikte bulunmaktadır.19
SENDROMİK HEREDİTER İŞİTME KAYBI ETKENLERİ
İşitme kaybı ile birlikte diğer sistemlere ait belirgin bulguların birlikte bulunduğu klinik görünümler sendromik tablolar oluşturmaktadır. Günümüzde işitme kaybına yol açan 300'ün üzerinde tanımlanmış sendrom vardır.20 Bu sendromların tümünde işitme kaybı klinik tabloya her zaman eşlik etmeyebiliyor. Ancak en sık ve belirgin bulgusu işitme kaybı olan bazı sendromları tartışacağız (tablo). Bu sendromların çoğunda görüntülenme teknikleriyle tespit edilebilecek bulgular bulunmasa da, tespit edilebilen özellikler tanı koydurucu nitelikte olabilmektedir.
BOR SENDROMU
Brankio Oto Renal sendrom OD geçişlidir. İK, aurikuler malformasyonlar, brankial ark kapanma defektleri (preaurikuler pit ve tag), böbrek anomalileri ile seyreder. Daha nadir olarak lakrimal kanal stenozu, dar ve uzun yüz, damak anomalileri, mesane ve üreter anomalileri de görülebilir. EYA1 (%40) ve SIX1 genlerinde mutasyonlar tanımlanmıştır.(4)
HL olguların %70-93'ünde görülür ve erken çocukluk çağından genç yetişkinliğe kadar değişen sürelerde ortaya çıkabilir. HL iletim tipi, SNİK ve miks tipte olabilir ve hafif derecelerden çok ileri dereceye kadar farklı şiddetlerde görülebilir.21
İç kulak anomalisi olarak özellikle apikal kohlear hipoplazi, fasial kanal labirent bölümünde kohleaya doğru deviasyon, porusu geniş olarak huni şeklinde İAK görülür (şekil 11).22 Ayrıca vestibüler displazi, SSK displazisi, GVA ve CND gibi anomaliler de rapor edilmiştir. BOR olgularında sıklıkla DKY stenozu veya atrezisi, Eustachian tüpü dilatasyonu ve stapes kası yokluğu da bildirilmiştir.22,23
Şekil 11: A.Modiolusun olmadığı hipoplazik kohlea. B.Fasial kanal labirenter bölümünün mediale yer değiştirmesi ve GVA. A-B.Aynı zamanda orta kulak kolesteatomuna bağlı destruksiyon alanları ve destrukte olmuş malleus görülmekte. C.Aynı hastanın diğer kulağında kalın ve kısa bir hipoplastik inkusun stapes ile direkt eklem yapması.
CHARGE SENDROMU
CHARGE sendromu 1981 yılında Pagon ve ark.tarafından akronim olarak tanımlanmıştır. Coloboma, Heart defects, Atresia of chonae, Retarded growth and developmeent, Genital hypoplasia ile Ear anomalie ve/veya sağırlık gibi 6 kardinal bulgunun baş harflerinin birleşimiyle oluşur. İlk tanımlanmasından sonra Rhombensefalik disfonksiyon, kranial nöropatiler, hipotalamo-hipofizyal aks disfonksiyonları rapor edilmiştir. Tanı kriterleri 2005 yılında Verloes tarafından yeniden tanımlanmıştır (tablo).24
CHARGE sendromu genellikle sporadik OD geçişlidir ve 8.kromozomda CHD7 geninde mutasyon gösterilmiştir. HL olguların %90'ında görülür ve iletim tipi, SNİK veya miks tipte olabilir.25 Aurikuler minimal anomaliler (küçük pinna, low set, keçe kulak, fincan kulak, geniş ancak vertikal boyutu küçük kepçe, vb) olguların tamamına yakınında görülür. BT ile küçük timpanik kavite, stapes kasının yokluğu, oval veya yuvarlak pencere yokluğu, inkus ve stapes hipoplazisi, kemikçik fiksasyonları, fasial sinir timpanik seyrinin anomalisi tespit edilebilir.26
CHARGE sendromunda karakteristik iç kulak bulgusu SSK aplazisi ve eşlik eden vestibüler displazi olup, hemen tüm olgularda görülür (şekil 12). CND ve kohlear aperture atrezisi, kohlea kıvrımları ve kranial sinir anomalileri, olfaktör bulbus anomalisi sık bulgulardır.26 Kemik yada membranöz koanal atrezi ve koloboma majör bulgulardır.
Şekil 12: CHARGE sendromu. A.Hipoplastik vestibül, lateral YDK aplazisi, hipoplastik kohlea. B.Koloboma
PENDRED SENDROMU
Sendromik konjenital işitme kayıpları içinde en sık Pendred sendromu görülür. Çocukluk çağı sağırlıklarının %4.3-7.5'nu oluşturur ve eutiroid guatr ile birlikte görülen OR geçişli bir hastalıktır. Guatr genellikle çocukluk çağının ortalarında görülür ve iyot metabolizmasındaki bozukluğa bağlı gelişir. Bu bozukluk perklorat atılım testiyle gösterilebilir.27 7q31 kromozomunda pds lokusunda mutasyon gösterilmiştir.28
BT ile mutlaka modiolar defektler ve vestibüler genişleme bulguları görülür, üst ve orta kohlea sarmallerinde interskalar septum %75 olguda gelişmemiştir, GVA %80 olguda bulunur.29 MR ile endolenfatik kese genişlemesi tüm olgularda saptanmaktadır.
WAARDENBURG SENDROMU
OD geçişli hastalığın en karakteristik bulguları hipertelerizm ve dystopia canthorum (burun kökünün çok geniş olması) olarak sayılabilir. Kaş hiperplazisi ve synophrys (kaşları bitişik olması), heterochromia iridis, beyaz perçem, lökoderma ve beyaz kirpikler gibi pigment bozuklukları ile SNİK görülür (şekil 13). Sendromun tanımlanmasından buyana 4 ayrı tipi ve daha birçok alt tipi bildirilmiştir ve en sık I. ve 2. tipleriyle karşılaşılır.30Değişik tipleri için 6 değişik gen tanımlanmıştır (PAX3, MITF, EDN3, EDNRB, SOX10, SNAI2).
Şekil 13: Waardenburg sendromunda A.Beyaz perçem, B.Heterokromia, C.Lökoderma
İK, tip I'de %60, tip 2'de %90 oranında görülür. Temporal kemik anomalileri olguların yaklaşık yarısında vardır.31 İç kulak anomalisi olarak GVA, üst vestibül genişlemesi, İAK hipoplazisi, küçük modiolus ve en karakteristik olarak posterior SCC aplazi veya hipoplazisi (kabaca %26) görülebilir (şekil 14).
Şekil 14: Posterior kanal gelişmemiş (ok) ve lateral kanal normal (okbaşı). Bu bulgu Waardenburg ve Alagille sendromu için tipiktir.
NANCE SAĞIRLIĞI
Genetik olarak X-linked geçişlidir ve "X-linked sağırlığı tip 3" olarak veya "X-linked sağırlık ve Stapes Gusher" olarak da adlandırılır. X kromozomunun DFN3 lokusundaki POU3F4 genindeki mutasyon sonucu fonksiyonunu kaybetmesiyle ortaya çıkar. X kromozomuna bağlı geçiş gösteren 4 farklı mutasyona bağlı konjenital sağırlık tipinin (diğer üçü DF2, DF4 ve DF6) yarısını oluşturur.32 Semptomatik olgular tipik olarak erkeklerdir ve doğumda var olan işitme azlığı 10 yaşından önce tam sağırlığa kadar ilerleme gösterir. Genellikle miks tip işitme kaybı oluşur, bazen sadece SNİK şeklinde de görülebilir. Vestibüler problemler de sıklıkla oluşur. Mutasyonlu geni taşıyan kız çocuklarında işitme genellikle normaldir ancak hafif orta derecede işitme kaybı da görülebilir.
Bu hastalıkta İAK fundusundaki lamina kribrosa defektli olmakta ve böylece subaraknoid aralıkla perilenfatik sistem doğrudan ilişki halinde bulunmaktadır. Bu ilişki sonucunda perilenf basıncının artması nedeniyle stapes tabanında fiksasyon meydana gelerek İTİK oluşmaktadır.33 Cerrahi sırasında stapes tabanına dokunulmasıyla meydana gelecek gusher ile SNİK gelişecektir.
BT ve MR ile genişlemiş bulböz İAK bulgusu vardır, kohlea aperture geniştir ve lamina kribrosa yoktur. Bazen kohlear hipoplazi, modiolar eksiklik, fasial sinir labirenter bölümünün kemik kanalında açıklık saptanabilir (şekil 15).33 GVA bulgusu da rapor edilmiştir.
Şekil 15: A.İAK bulböz görünümde, kribriform plate eksikliği, kohlear aperture genişliği, kohlear hipoplazi, küçük modiolus vardır. B.Fasial sinir labirenter bölüm kemik kanal açıklığı
ÇOCUKLARDA ANDERSON-FABRY HASTALIĞI (AFD)
Majör organ hasarları erişkin yaşta oluşursa da, çocukluk çağında da sıklıkla pek çok bulgu saptanabilir. Semptomlar erkeklerde daha erken başlar. Tinnitus ve işitme kaybının yanında akroparaesthesia, kronik nöropatik ağrı, hipo-anhidrosis, karın ağrısı ve diare, anjiokeratoma, kornea verticillata, retinal damarlarda bükülmeler, subkapsüler katarakt gibi yakınma ve bulgular da bulunur. Majör organ tutulumunun bulgusu olarak mikroalbumineri veya proteinüri, aritmi, sol ventrikül hipertrofisi, inme gibi bulgular çocukluk çağında görülebilir. Agalsidase alfa ve beta enzimlerinin verilmesiyle tedavi çalışmaları ümit vericidir ve kalıcı hasarlar oluşmadan başlanmalıdır.34
MUCKLE-WELLS SENDROMU
Muckle-Wells sendromu (MFS) ve Ailesel soğuk otoinflamasyon sendromu (Familial cold autoinflammatory syndrome-FCAS) gibi klinik antiteler, kriopirin-bulunan periodik sendromlar (cryopyrin-associated periodic syndromes-CAPS) grubundandır. CIAS1 gene mutasyonları bulunur. En hafif FCAS fenotipidir ve doğumdan sonra ilk aylarda soğukla karşılaşan bebeklerde bulgular ortaya çıkar. FACS olgularının kazanılan soğuk ürtikeri (acquired cold urticaria-ACU) and ailesel atipik soğuk ürtikeri (familial atypical cold urticaria-FACU) olgularından ayırıcı tanısının yapılması gerekir. MWS olgularında majör bulgu olarak SNİK, sekonder amiloidozis bulunurke, ayrıca rekürren ateş, ürtiker tipi rashlar klinik olarak ciddi boyutlarda değildir.35
HANGİ OLGULARDA GENETİK ARAŞTIRMA YAPILMALI
Bilateral işitme kaybı bulunup da, bilinen başka bir etiyolojik faktör saptanamayan çocuklardan genetik araştırma istenebilir. Tek taraflı işitme kayıplarında spesifik bir iç kulak anomalisi saptanan olgular genetik araştırmaya aday olabilir. Sendromik olgularda klinik fenotipten yola çıkarak hangi kromozomun araştırılacağını saptamak nispeten kolaydır ancak non-sendromik olgularda tek klinik bulgu nonspesifik olarak SNİK'dır. İlgili kromozomu saptamak için radyolojik çalışmalar, genetik geçiş özelliği, belki elektrofizyolojik test sonuçları yol gösterici olabilir. İlgili genin seçimine yönelik tanımlanmış bazı algoritimler vardır (algoritm tablosu).36
SORUMLU GENİN SAPTANMASININ HASTAYA FAYDASI NEDİR
Genetik araştırmalar maliyeti yüksek çalışmalardır. Saptanan genetik mutasyonun neden olacağı anomaliler de her zaman kesin değildir. Buna rağmen genetik bir hastalıkta sorumlu genin bulunmasının pek çok faydası da olacaktır. Bunları şu şekilde sıralayabiliriz.
1. İK bulunan hastalar ve yakınları tanının kesinliğinden tam emin olamazlar ve pek çok sağlık kurumu dolaşarak defalarca işitme testleri yaptırmak isteyeceklerdir. Ayrıca işitme kaybı dışında beraberinde henüz tespit edilemeyen başka problemlerin olabileceği ayrı bir anksiyete kaynağı oluşturacaktır. Bu belirsizlik işitme rehabilitasyonuna başlamayı da geciktirebilecektir.37
2. Genetik mutasyonun kesinleşmesi odyogramın ve işitme kaybının muhtemel seyri hakkında doktora yol gösterici olacaktır. Unutulmamalı ki bu grup hastaların yaşları nedeniyle subjektif odyogramların elde edilmesi söz konusu değildir. Bu bilgiler ışığında rehabilitasyon ve ileriye yönelik planlamalar daha net yapılabilecektir.38
3. İlgili genin ve dolayısıyla olabilecek anomalilerin anlaşılması zararlı olabilecek ilaçlardan ve aktivitelerden kaçınılması konusunda uyarıcı olacaktır. Örneğin A1555Gmitokondrial DNA mutasyonunda tek doz aminoglikozid kullanılmasıyla dahi İK oluşabilmektedir.39 Diğer bir örnek olarak SLC26A4 geni GVA anomalisine işaret eder ve bu hastalarda aşırı eksersizler, küçük kafa travmaları vb ile İK başlayabilir veya ilerleyebilir.
4. Saptanan gen İK ile birlikte görülebilecek diğer anomalilere işaret edebilir. Örneğin A3243G mitokondrial DNA mutasyonunda DM, SLC26A4 mutasyonunda guatr bulunabilir. Bu bilgiler muhtemel bir diyabetik retinopatiyi, hipotrioidism gibi tablolar için alınacak önlemlere ışık tutar. Örneğin , Alport sendromunun anlaşılması için renal biyopsi yerine genetik test yapmak daha non-invazivdir.40
5. Gen tipi İK patogenezindeki iç kulak hasarına ve hücre tipine işaret edebilir. Örneğin spiral ganglion hücrelerinin durumu CI cerrahisinden alınacak başarıyı doğrudan etkileyebilen bir faktördür. Auditör nöropatiye işaret eden spesifik genler tanımlanmıştır ve bu klinik tabloda dış saçlı hücreler normal olduğu halde, iç saçlı hücrelerde ve/veya işitme sinirinde anormal aktiviteler bulunmaktadır ve konjenital SNİK olgularının yaklaşık %15'ni oluşturur. Bu olgularda konuşmayı algılama bozuk olduğu için dil gelişimi işitme cihazı ile rahabilite edilemez. Auditör nöropatinin iç saçlı hücrelerden mi, yoksa spiral ganglion hücrelerden mi kaynaklandığı, CI ile rehabilitasyon için önemlidir. OTOF genindeki mutasyonda iç saçlı hücrelerde etkilenmeyle auditör nöropati oluşur ve spiral ganglion hücreri sağlam olduğu için CI başarıyla uygulanabilir.41 Bu mutasyonun yol açtığı hücresel etkilenmeler patolojik çalışmalarla da desteklenmiştir.
6. Genetik çalışmalar daha sonraki gebeliklerin planlanması için de önem arzeder. Non sendromik genetik hastalıklar için prenatal genetik çalışmalar yapılması ve bunlara göre gebeliğin sonlandırılması günümüzde etik bulunmamaktadır.
7. Henüz hayvan deneyleri seviyesinde olmasına rağmen bozuk olduğu tespit edilen genler, genetik tedavi ile olabilecek anomaliler hücresel düzeyde önlenebilmektedir. Örneğin kohlear fibrosit anomalileri bazı genetik SNİK, ayrıca gürültüye bağlı, yaşlanmaya bağlı ve Meniere hastalığı gibi İK tablolarında tespit edilmiştir. Farelerde deneysel olarak bir tür mitokondrial toksin olan 3-NP kullanılarak kohlear fibrosit anomalisi oluşturacak gen mutasyonu indüklenmiş. Daha sonra kohlear fibrositlerde apopitozis gelişimi sırasında caspase inhibitörü olarak Z-VAD-FMK kullanılarak fibrosit hasarı düzeltilebilmiştir. Hatta bu madde 3-NP kullanılmasından önce verildiğinde tespit edilen bir yan etki olmaksızın apopitozis gelişimini önlemiştir. Ayrıca kohlear fibrositlerde apopitozis sürerken ve kronik bir etkilenmeyle SNİK ilerlemesi olurken, farelere kemik iliğinden elde edilen stem-cell verildiğinde, bu hücrelerin hasarlı bölgeye ulaşarak, hasar gören fibrositlerin yerini aldığı histopatolojik olarak gösterilmiştir.42
NON-HEREDİTER İŞİTME KAYIPLARI
Konjenital işitme kayıplarının yaklaşık yarısı non-herediterdir ve bu olguların yaklaşık yarısı çevresel faktörlere bağlı oluşur. Etiyoljik faktör olarak;43
i. pre ve perinatal infeksiyonlar (CMV, rubella, kızamık, sifiliz, vb)
ii. toksikasyon (alkol, ototoksik ilaçlar-aminoglikozidler, antineoplastik ajanlar),44
iii. erken doğum
iv. hipoksik-iskemik doğum
v. hiperbillurubinemi sıralanabilir. Bu tip patolojiler radyolojik olarak tespit edilebilen gros bulgular oluşturmazlar.
CMV ENFEKSİYONLARI
CMV enfeksiyonu gelişmiş ülkelerde rubella enfeksiyonunun kontrolü sonucunda en sık çevresel prelingual SNİK etkeni olarak karşımıza çıkmaktadır. Konjenital infantil işitme kayıplarının %10'nu, geç dönemde başlayan idiopatik orta-ciddi SNİK'lerin yaklaşık üçte birini oluşturur. Maternal seroimmünitenin varlığı sekel riskini azaltır şeklinde yanlış bir kanı vardır. Son dönemlerdeki çalışmalar primer yada nonprimer maternal enfeksiyonların her ikisinin de özellikle İK sekeli olarak benzer riskler oluşturduğu bildirilmektedir.45 Öte yandan ilk CMV aşılarıyla ilgili raporlar, maternal enfeksiyona bağlı konjenital CMV enfeksiyonunun azaltılabileceğine işaret etmektedir. Zayıflatılmış human CMV kullanılmasıyla elde edilen Ab indüksiyonu başarılı gibi görünmektedir. Ancak endotelyal ile epitelyum hücrelerine ve lökositlere karşı oluşan antikorların nötrelizasyonu henüz başarılamamıxtır.46
Kabaca konjenital CMV enfeksiyonlarının %90'ı subklinik seyir gösterir, ancak bunların yaklaşık %10'u ciddi kalıcı SNİK oluşturur. Klinik olarak belirgin şekilde seyreden CMV enfeksiyonlarında %30 oranında SNİK gelişmektedir. CMV enfeksiyonuna bağlı SNİK tablosu tek taraflı, fluktuasyon gösteren özellikte veya progresif tipte olabilir. İşitme kaybının başlayışı aylar veya yıllar sonra oluşabilir. CMV nedeniyle oluşan konjenital SNİK olgularında iç kulak bulguları tipik değildir, fakat beyin MR T2 görüntüleri beyaz cevherde hiperintens bulgular ve kortikal malformasyonlar %80 oranında saptanabilir.47 Tedavisinide ganciclovir ve valganciclovir gibi antiviral ajanlar denenmektedir.48
KAZANILMIŞ SNİK
Kazanılan tip İK daha geç çocukluk çağında görülürler ve iç kulak enfeksiyonları, otoimmün hastalıklar, travma veya posterior fossa yada İAK tümörleri gibi etkenlerle meydana gelirler.
LABİRENTİT
Mebranöz labirentin inflamasyonuyla tipik olarak İK ve vertigo oluşur. Labirentitler
a. İnfeksiyöz
i. Bakteriyel
ii. Viral
iii. Luetic
b. Non-infeksiyöz
i. Travmatik
ii. Otoimmün
iii. Toksik
gibi etkenlerine göre sınıflanabilir. İnfeksiyöz labirentitler ise enfeksiyonun yayılış yoluna göre ayrıca;
i. Timpanogenik
ii. Meningogenik
iii. Hematogenik
olarak da sınıflanabilir.
İNFEKSİYÖZ LABİRENTİTLER
Çocukluk çağında en sık postnatal kazanılan işitme kaybı etkeni olarak Menenjitler görülmektedir. Meningojenik labirentit en çok bakteriyel menenjiti takiben gelişir ve genellikle bilateral oluşur. Bakteri kohlear aquaduct veya kribriform laminadan geçerek membranöz labirente ulaştığına inanılır. Timpanojenik enfeksiyonların labirente yuvarlak veya oval pencere yoluyla yada orta kulak-iç kulak arasındaki anormal bir bağlantı yoluyla yayılabilir. Bu yolla gelişen labirentitler genellikle unilateraldir. Hematojenik olarak genellikle viral bir etken kan dolaşımı yoluyla labirente ulaşır. En sık görülen kazanılmış tip viral enfeksiyonlar ise Kızamık, kabakulak, influenza, rubella, CMV ve herpes olarak sayılabilir.49 Viral labirentitler tipik olarak kendi kendini sınırlar ve herhangi bir radyolojik incelemeye gerek kalıncaya kadar işitme kaybı düzelebilir ve hatta tamamen iyileşebilir.
Klinik ve Radyolojik olarak labirentitler 3 evre gösterirler:
i. Akut evre
i. Fibröz evre
iii. Labirentitis ossifikans.
Akut evrede kan-beyin bariyerinin kalkması nedeniyle perilenf inflamatuar hücreler ve serofibrinöz eksuda ile kaplanır. Bu evrede godolinyumlu MR-TI sekanslarda labirentde kontrast tututulumu görülür ancak bu durum infeksiyöz labirentite spesifik olmayıp, non-infeksiyöz labirentitlerde de bulunabilir. BT ile iç kulak bulguları normaldir, timpanojenik labirentit söz konusuysa orta kulağın tutulumuna ait bulgular görülür.
2 hafta içinde fibröz labirentit evresine geçiş olur. Labirent hipertrofik fibroblastlardan oluşan granulasyon dokusu ile dolarak, normal sıvı görünümü değişmiş olur.49 MR-T1 sekansta akut fazdaki kadar olmasa da hiperintens görünümü bulunur.43 BT ile hala herhangi bir opasifikasyon görünmeyecektir (şekil 16).
Şekil 16: A. İAK seviyesinden geçen kesitte kohlea içindeki yüksek sıvı intensitesinde azalma görülmektedir. B.Kohlea içinde henüz bir ossifikasyon olmasa da, modiolus seviyesinde hafif ossifikasyona bağlı kalınlaşma görülmektedir.
Labirentittin son aşaması olan ossifikasyon evresinde, BT ile iç kulağı dolduran metaplastik veya osteoplastik kemik formasyonuna ait görüntüler tespit edilebilir (şekil 17). Ossifikasyon genellikle yuvarlak pencere komşuluğundaki skala timpaniden başlayarak apikal bölüme doğru yayılır.(32,33) MR ile labirent içinde sıvı sinyalleri azalmıştır ve fibröz evredeki gibi T1 sekansta kontrast tutulumu olmamaktadır. MR ile fibröz ve ossifikasyon evreleri birbirinden ayrılamaz, ancak BT ile ossifikasyon net olarak saptanabilmektedir. Bu iki klinik tablonun ayırt edilebilmesi CI adaylarının belirlenebilmesi için önemlidir. Labirent ossifikasyonunda CI uygulaması imkansız değildir ancak sonuçlar çok daha kötüdür.
Labirentin tam ossifikasyonu durumunda klinik tablonun labirent aplazisinden ayrılabilmesi için, iç kulak yapılarının boyutları ve İAK anatomik yapısı önemlidir.50
Şekil 17: A.Labirent ossifikasyonu nerdeniyle kohlea bazal döngüsü içinde artmakta olan dansite artışı görünmekte. B.Orta kulak cerrahisi geçirmiş bir kulakta kohlea ve labirentin büyük bölümü total ossifikasyon geliştirmiş ve ancak vestibülün bir bölümü açık kalmıştır. Labirenter aplaziden farklı olarak İAK normal boyutlardadır.
OTOİMMÜN LABİRENTİT
Genellikle hızlı ilerleme gösteren fluktuasyon özellikte bilateral SNİK tablosu oluştururlar ve immunsupresif ajanlara iyi cevap verirler. Vestibüler semptomları Menire hastalığına benzer. ESR, RF, CRP veya serum Ig oranlarında artış görülür. Ayrıca dokuya özel olmayan antikor titrelerinde (ANA, Anti-Nötrofil Cytoplasmic Antibody, Anti-endotelyal Hücre Antibody) yükselmeler saptanabilir.
Otoimmun HL oluşturan antiteler;
i. Cogan sendromu
ii. SLE
iii. Juvenil idiopatik artrit (Juvenil Romatoid artrit)
iv. Wegener granulomatozis
v. Sjögren sendromu
vi. Behçet hastalığı
vii. Anti-fosfolipid sendromu
viii. Anti-cardiolipin sendromu
ix. Hashimoto tiroiditi
olarak sıralanabilir. Otoimmün labirentitlerin prevelansı yaşla birlikte artar ve çocukluk çağında en sık geç adölesan yaşta görülür.51
MR ile T1 sekansta kontrast sonrası akut infeksiyöz labirentite benzer şekilde labirentde intensite artışı görülür (şekil 18).49 Bu radyolojik bulgular steroid tedavisiyle kaybolur ve bazen fibröz veya ossifiye labirentite doğru ilerleme gösterebilir.
Şekil 18: Godolonium sonrası kohlea, vestibül ve YDK intensitelerinde artış görülmesi. Benzer görünüm akut infeksiyöz labirentitde de bulunur.
TRAVMALAR
Temporal kemik fraktürleri, barotravmalar veya akustik travmalar bu başlık altında incelenebilir.
Fraktürler:
Çocuklardaki temporal kemik travması sonrası %80 gibi bir oranda İK gelişebilmektedir. Bunların yarısından çoğu İTİK, beşte biri SNİK ve onda biri miks tipte olmaktadır.52 Vertikal fraktürlerden daha çok transver fraktürlerin İAK veya labirentden geçmesiyle İK meydana gelmektedir (şekil 19). Yine transvers fraktürlerde sıklıkla fasial paraliziler de görülmektedir. En sık görülen fraktürler ise longitudinal olanlardır. Bu ayırımlar klinik tabloların açıklaması için faydalıdır ancak gerçekte temporal kemik fraktürleri miks formda veya obliq olabilmektedir.
Şekil 19: A.Superior kanal hizasından geçen kesitte kanala uzanan horizontal fraktür hattı. B. İAK hizasından geçen kesitte kohlea, vestibül ve vestibüler aquaduct içinde gaz görümü pnömolabirent lehinedir.
Bazen travma sonrası fraktür olmaksızın da labirent kontüzyonu nedeniyle SNİK gelişebilmektedir. Muhtemelen membraröz labirenti etkileyen görünemeyen mikrofraktürler oluşabilir. Fizyopatolojik olarak öne sürülen hipotezler şu şekilde sıralanabilir;
i. BOS aracılığıyla iletilen basınç dalgaları sonucunda kohleanın membranöz bölümünde kopmalar olabilir.
ii. Travmaya bağlı kohlear mikrosirkülasyon bozulabilir.
iii. Kohlea içine kanama olabilir (Şekil 20).53
Bu olgularda kemik kapsül ve İAK BT'de intakt görülür. MR ile kohlea veya labirent içine oluşan kanama TI sekansta hiperintens olarak görülebilir. Hemolabirint tablosu da labirent ossifikasyonuna gidebilir.
Şekil 20: Travma sonrası MR'da, kontrast kullanılmaksızın, T1 sekansta kohlea içindeki intensite artışı hemotimpanum lehinedir.
Perilenfatik Fistül:
Yine travmalara bağlı perilenfin orta kulak boşluğuna kaçak oluşturması perilenfatik fistül olarak isimlendirilir ve SNİK ve vertigo oluşur. Fistül olgularında açık bir fraktür hattı olmayabilir. Fistüller spontan veya barotravmalar sonucunda da oluşabilmektedir. Böyle durumlarda fistül hattı sıklıkla yuvarlak veya oval pencere yoluyla meydana gelir. Bu olguların BT görüntülerinde sıklıkla orta kulaktaki sıvı bazen pnömolabirent saptanabilir .54 Perilenf fistülleri kolesteatomaya veya kronik otitis mediaya bağlı en sık lateral YDK dehisansları ile membranöz labirent erozyonları sonucunda da oluşabilir.
TÜMÖRLER
İAK, CPA veya beyin sapı yerleşimli tümörlere bağlı santral SNİK olguları görülebilmektedir. Özellikle NF-2 bulunan olgularda vestibüler schwannoma sonucunda İK gelişebilmektedir. NF-2 olgularının yaklaşık beşte biri 15 yaşın altında ortaya çıkar ve bunların yine beşte birinde başlangıç semptomu olarak tinnitus ve HL meydana gelir.55 Bu tip olgulardaki İK progresif özelliktedir ve unilateral veya bilateral tutulum gösterebilirler. Bu olguların radyolojik incelemesinde intrakranial multipl schwannomalar ve meningiomlar görülür (şekil 21).
Şekil 21: Godoloniumlu MR T1 sekansta her iki İAK yerleşimli vestibüler ve, her iki Meckel cave yerleşimli trigeminal schwannomalar görülmektedir.
Ayrıca posterior fossa yerleşimli beyin sapı pilocytic astrositomlar, medulloblastomlar ve serebellopontin açı araknoid kistleri gibi tümörler de çocuklarda SNİK etkeni olarak görülebilir.
REFERANSLAR
*Huang BY, Zdanski C, Castillo M. Pediatric Sensorineural Hearing Loss, Part 1:Practical Aspects for Neuroradiologists. Am J Neuroradiol 2012;33:211-7.
**Huang BY, Zdanski C, Castillo M. Pediatric Sensorineural Hearing Loss, Part 2: Syndromic and Acquired Causes. Am J Neuroradiol 2012;33:399-406.
1. Billings KR, Kenna MA. Causes of pediatric sensorineural hearing loss: yesterday and today. Arch Otolaryngol Head Neck Surg 1999;125:517–21
2. American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics 2007;120:898–921
3. Buchman CA, Adunka OF, Zdanski CJ, et al. Hearing loss in children: the otologist's perspective. In: Seewald RC, Bamford JM, eds. A Sound Foundation Through Early Amplification: Proceedings of the Fourth International Conference. Basel, Switzerland: Phonak; 2008:63–77
4. Trimble K, Blaser S, James AL, et al. Computed tomography and/or magnetic resonance imaging before pediatric cochlear implantation? Developing an investigative strategy. Otol Neurotol 2007;28:317–24
5. Hone SW, Smith RJ. Medical evaluation of pediatric hearing loss: laboratory, radiographic, and genetic testing. Otolaryngol Clin North Am 2002;35:751–64
6. McClay JE, Booth TN, Parry DA, et al. Evaluation of pediatric sensorineural hearing loss with magnetic resonance imaging. Arch Otolaryngol Head Neck Surg 2008;134:945–52
7. Morton CC, Nance WE. Newborn hearing screening: a silent revolution. N Engl J Med 2006;354:2151–64
8. Denoyelle F, Marlin S, Weil D, et al. Clinical features of the prevalent form of childhood deafness, DFNB1, due to a connexin-26 gene defect: implications for genetic counseling. Lancet 1999;353:1298–303
9. Azaiez H, Smith RJ. In reference to temporal bone imaging in GJB2 deafness. Laryngoscope 2007;117:1127, author reply 1127–29
10. Propst EJ, Blaser S, Stockley TL, et al. Temporal bone imaging in GJB2 deafness. Laryngoscope 2006;116:2178–86
11. Arcand P, Desrosiers M, Dube J, et al. The large vestibular aqueduct syndrome and sensorineural hearing loss in the pediatric population. J Otolaryngol 1991;20:247–50
12. Swartz JD. An overview of congenital/developmental sensorineural hearing loss with emphasis on the vestibular aqueduct syndrome. Semin Ultrasound CT MR 2004;25:353–68
13. Sennaroglu L, Saatci I. A new classification for cochleovestibular malformations. Laryngoscope 2002;112:2230–41
14. Reardon W, OMahoney CF, Trembath R, et al. Enlarged vestibular aqueduct: a radiological marker of Pendred syndrome, and mutation of the PDS gene. QJM 2000;93:99–104
15. Koch B, Goold A, Egelhoff J, et al. Partial absence of the posterior semicircular canal in Alagille syndrome: BT findings. Pediatr Radiol 2006;36:977–79
16. Papsin BC. Cochlear implantation in children with anomalous cochleovestibular anatomy. Laryngoscope 2005;115(1 pt 2 suppl 106):1–26
17. Glastonbury CM, Davidson HC, Harnsberger HR, et al. Imaging findings of cochlear nerve deficiency. AJNR Am J Neuroradiol 2002;23:635–43
18. Adunka OF, Jewells V, Buchman CA. Value of computed tomography in the evaluation of children with cochlear nerve deficiency. Otol Neurotol 2007;28:597–604
19. Huang BY, Roche JP, Buchman CA, et al. Brain stem and inner ear abnormalities in children with auditory neuropathy spectrum disorder and cochlear nerve deficiency. AJNR Am J Neuroradiol 2010;31:1972–79. Epub 2010 Jul 1
20. Morton CC, Nance WE. Newborn hearing screening: a silent revolution. N Engl J Med 2006;354:2151–64
21. Kochhar A, Fischer SM, Kimberling WJ, et al. Branchio-oto-renal syndrome. Am J Med Genet A 2007;143A:1671–78
22. Propst EJ, Blaser S, Gordon KA, et al. Temporal bone findings on computed tomography imaging in branchio-oto-renal syndrome. Laryngoscope 2005;115:1855–62
23. Senel E, Gulleroglu BN, Senel S. Additional temporal bone findings on computed tomography imaging in branchio-oto-renal syndrome. Laryngoscope 2009;119:832
24. Verloes A. Updated diagnostic criteria for CHARGE syndrome: a proposal. Am J Med Genet A 2005;133A:306–08
25. Sanlaville D, Verloes A. CHARGE syndrome: an update. Eur J Hum Genet 2007;15:389–99
26. Morimoto AK, Wiggins RH 3rd, Hudgins PA, et al. Absent semicircular canals in CHARGE syndrome: radiologic spectrum of findings. AJNR Am J Neuroradiol 2006;27:1663–71
27. Reardon W, Trembath RC. Pendred syndrome. J Med Genet 1996;33:1037–40
28. Coyle B, Coffey R, Armour JA, et al. Pendred syndrome (goitre and sensorineural hearing loss) maps to chromosome 7 in the region containing the nonsyndromic deafness gene DFNB4. Nat Genet 1996;12:421–23
29. Goldfeld M, Glaser B, Nassir E, et al. BT of the ear in Pendred syndrome. Radiology 2005;235:537–40
30. Pingault V, Ente D, Dastot-Le Moal F, et al. Review and update of mutations causing Waardenburg syndrome. Hum Mutat 2010;31:391–406
31. Cullen RD, Zdanski C, Roush P, et al. Cochlear implants in Waardenburg syndrome. Laryngoscope 2006;116:1273–75
32. Petersen MB, Wang Q, Willems PJ. Sex-linked deafness. Clin Genet 2008;73:14–23
33. Kumar G, Castillo M, Buchman CA. X-linked stapes gusher:BTfindings in one patient. AJNR Am J Neuroradiol 2003;24:1130–32
34. Sestito S1, Ceravolo F, Concolino D. Anderson-Fabry disease in children. Curr Pharm Des. 2013;19(33):6037-45.
35. Calvo Penadés I1, López Montesinos B, Marco Puche A Syndrome of Muckle-Wells and to inflammatory familiar syndrome induced by cold. Med Clin (Barc). 2011 Jan;136 Suppl 1:16-21. doi: 10.1016/S0025-7753(11)70004-5.
36. Matsunaga T. Value of Genetic Testing in the Otological Approach for Sensorineural Hearing Loss Kerio J Med 2009; 58(4): 216-22
37. Yoshinaga-Itano C, Sedey AL, Coulter DK, Mehl AL: Language of early- and later-identified children with hearing loss. Pediatrics 1998; 102: 1161-1171
38. Matsunaga T, Hirota E, Bito S, Niimi S, Usami S: Clinical course of hearing and language development in GJB2 and non-GJB2 deafness following habilitation with hearing aids. Audiol Neurootol 2006; 11: 59-68
39. Usami S, Abe S, Kasai M, Shinkawa H, Moeller B, Kenyon JB, Kimberling WJ: Genetic and clinical features of sensorineural hearing loss associated with the 1555 mitochondrial mutation. Laryngoscope 1997; 107: 483-490
40. Gubler MC: Diagnosis of Alport syndrome without biopsy? Pediatr Nephrol 2007; 22: 621-625
41. Yasunaga S, Grati M, Cohen-Salmon M, El-Amraoui A, Mustapha M, Salem N, El-ZirE, Loiselet J, Petit C: A mutation in OTOF, encoding otoferlin, a FER-1-like protein, causes DFNB9, a nonsyndromic form of deafness. Nat Genet 1999; 21: 363-369
42. Mizutari K, Matsunaga T, Kamiya K, Fujinami Y, Fujii M, Ogawa K: Caspase inhibitor facilitates recovery of hearing by protecting the cochlear lateral wall from acute cochlear mitochondrial dysfunction. J Neurosci Res 2008; 86: 215-222
43. Lemmerling MM, De Foer B, Verbist BM, et al. Imaging of inflammatory and infectious diseases in the temporal bone. Neuroimaging Clin N Am 2009;19:321–37
44. Greval S, Merchant T, Reymond R, et.al. Auditory late effects of childhood cancer therapy: a report from the children's oncology group. Pediatrics 2010; 125(4):938-50.
45. Manicklal S, Emery VC, Lazzarotto T, et.al. The "Silent" Global Burden of Congenital Cytomegalovirus Clinical Microbiology Review 2013; 26: 86-102.
46. Fu TM, An Z, Wang D. Progress on pursuit of human cytomegalovirus vaccines for prevention of congenital infection and disease Vaccine 2014; 32:2525-33.
47. Kimani JW, Buchman CA, Booker JK, et al. Sensorineural hearing loss in a pediatric population: association of congenital cytomegalovirus infection with intracranial abnormalities. Arch Otolaryngol Head Neck Surg 2010;136:999–1004
48. Buonsenso D1, Serranti D, Gargiullo L, Ceccarelli M, Ranno O, Valentini P. Congenital cytomegalovirus infection: current strategies and future perspectives. Eur Rev Med Pharmacol Sci. 2012 Jul;16(7):919-35.
49. Hegarty JL, Patel S, Fischbein N, et al. The value of enhanced magnetic resonance imaging in the evaluation of endocochlear disease. Laryngoscope 2002;112:8–17
50. Marsot-Dupuch K, Dominguez-Brito A, Ghasli K, et al. BT and MR findings of Michel anomaly: inner ear aplasia. AJNR Am J Neuroradiol 1999;20:281–84f
51. Agrup C. Immu!!ne-mediated audiovestibular disorders in the paediatric population: a review. Int J Audiol 2008;47:560–65
52. Lee D, Honrado C, Har-El G, et al. Pediatric temporal bone fractures. Laryngoscope 1998;10 816–21
53. Fitzgerald DC. Head trauma: hearing loss and dizziness. J Trauma 1996;40:488–96
54. Minor LB. Labyrinthine fistulae: pathobiology and management. Curr Opin Otolaryngol Head Neck Surg 2003;11:340–46
55. Neff BA, Welling DB. Current concepts in the evaluation and treatment of neurofibromatosis type II. Otolaryngol Clin North Am 2005;38:671– 84, ix.